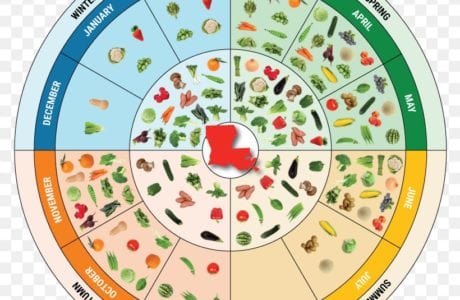
Despite the fact that there are hundreds of fast weight loss diets in the world, long-term results can be achieved only by drastically changing your lifestyle. In addition to diets for weight loss, diets for maintaining individual organs, sports diets, diets for diseases occupy an important place in the world of diets. This page also contains a section on seasonal and special purpose diets. Let’s consider the main ones and make sure of this!
2021-04-20